O diabetes mellitus (DM) é uma condição conhecida pela medicina há milênios, com descrições encontradas no Antigo Egito há cerca de 3 mil anos, bem como na Roma Antiga. Durante séculos, a medicina careceu de tratamentos eficazes para essa condição — o diagnóstico de diabetes, à época, era praticamente uma sentença de morte.
A descoberta da insulina por Frederick Banting, em 1922, revolucionou o tratamento do diabetes mellitus, aumentando significativamente a expectativa de vida dos pacientes acometidos pela doença1. Desde então, o tratamento do DM evoluiu de maneira notável, com o desenvolvimento de insulinas mais eficazes, hipoglicemiantes orais e, mais recentemente, os análogos das incretinas — os agonistas do receptor do peptídeo semelhante ao glucagon tipo 1 (GLP-1RA). Os hormônios incretinas são secretados principalmente pelas células L enteroendócrinas do intestino distal.
Essa nova classe de medicamentos regula os níveis glicêmicos e promove maior controle da saciedade gástrica. Inicialmente aprovados para o tratamento do diabetes tipo 2, os agonistas dos receptores de GLP-1 também passaram a ser utilizados para o controle do peso corporal2,3. O uso dessas medicações tem crescido rapidamente em todo o mundo, incluindo o Brasil.
Os análogos do GLP-1 (como a semaglutida) mimetizam hormônios naturais do intestino, estimulando a secreção de insulina, retardando o esvaziamento gástrico e aumentando a saciedade4. Além de eficazes na redução da glicemia e da hemoglobina glicada (HbA1c), evidências apontam para seus efeitos anti-inflamatórios, neuroprotetores, e para a redução de eventos cardiovasculares e da progressão da doença renal5,6.
Entretanto, a comunidade oftalmológica tem voltado atenção para essa classe terapêutica devido a possíveis efeitos adversos na retina e no nervo óptico.
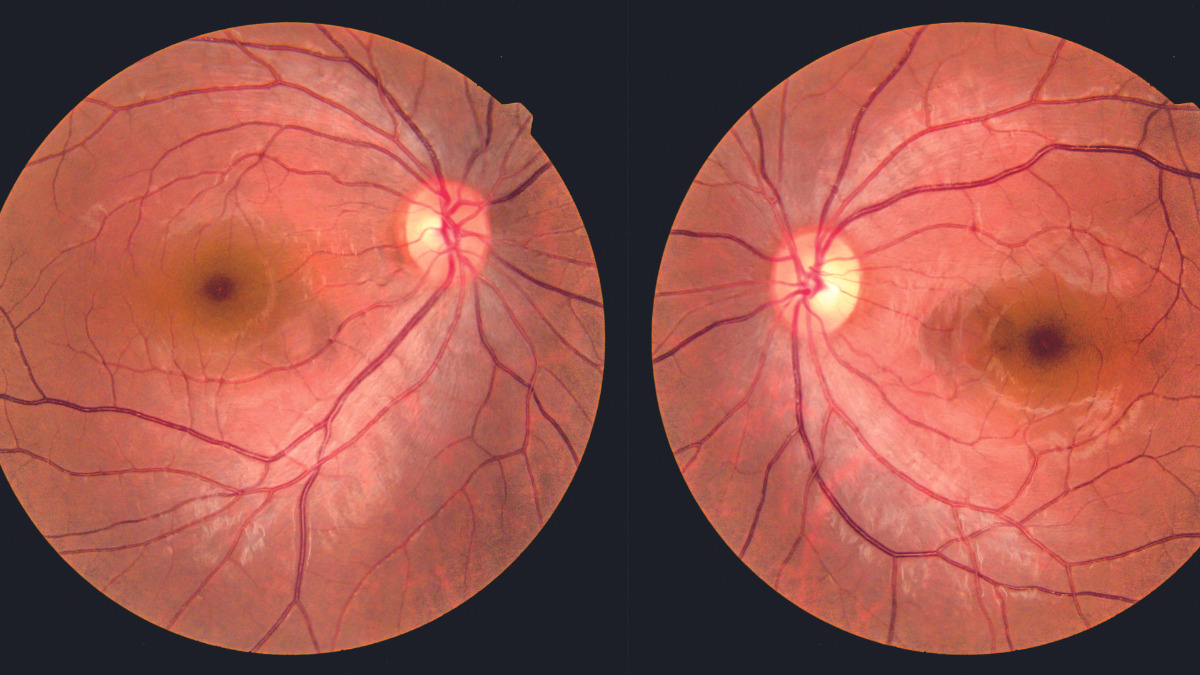
O estudo SUSTAIN-6, que avaliou a eficácia da semaglutida em pacientes com diabetes tipo 2 e alto risco cardiovascular, demonstrou redução significativa de eventos cardiovasculares. Porém, observou-se um aumento de 76% na progressão da retinopatia diabética (RD), incluindo maior necessidade de fotocoagulação a laser, aplicações intravítreas de anti-VEGF, vitrectomia e aumento do risco de cegueira7. A taxa de complicações foi de 3,0% no grupo tratado com semaglutida versus 1,8% no grupo placebo (HR: 1,76; IC95%; p=0,02).
Vale ressaltar que estudos como o SUSTAIN-6 não foram desenhados especificamente para avaliar a progressão da RD, e a piora observada foi considerada um achado secundário. Mesmo assim, esse dado levantou preocupações importantes na prática clínica.
Uma meta-análise dos estudos LEADER, PIONEER-6, SUSTAIN-6, EXSCEL, HARMONY e REWIND demonstrou que o uso crônico dos GLP-1RA apresentou aumento do risco de piora da RD. Contudo, meta-análises dos estudos SUSTAIN 1-5 e dois CVOTs japoneses não encontraram associação entre o uso de semaglutida e risco aumentado de RD8,9.
Entre os mecanismos propostos para essa piora está o rápido controle glicêmico — fenômeno já descrito com o uso intensivo de insulina desde os anos 198010. A redução abrupta da glicemia pode induzir hipóxia relativa na retina, promovendo aumento da expressão do VEGF e consequente progressão da RD. No SUSTAIN-6, muitos pacientes apresentaram queda acentuada da HbA1c nos primeiros três meses, o que pode ter contribuído para esse desfecho11.
Outra hipótese envolve uma ação direta do GLP-1RA nas células da retina, que expressam receptores para GLP-1. A ativação desses receptores poderia induzir a elevação de CXCL12, promovendo estado de hipóxia e aumento da expressão de VEGF. Estudos pré-clínicos mostram que o GLP-1 pode exercer efeitos neuroprotetores em células ganglionares da retina, mas ainda não há consenso sobre seu impacto direto na fisiopatologia da RD em humanos12.
Mais recentemente, sugeriu-se que o uso crônico de GLP-1RA poderia estar associado ao aumento do risco de degeneração macular relacionada à idade em usuários crônicos, possivelmente pela hipóxia induzida após o rápido restabelecimento dos níveis glicêmicos. No entanto, esses dados são preliminares e ainda necessitam de validação em estudos clínicos de maior escala13.
Outros achados também corroboram a preocupação com a segurança do tratamento sistêmico com análogos de GLP-1. Um estudo retrospectivo com 16.827 pacientes com diabetes demonstrou aumento do risco de neuropatia óptica isquêmica anterior não arterítica em pacientes em uso de semaglutida. A possível explicação para esse fenômeno seria a hipóxia induzida pelo tratamento14.
Os análogos de GLP-1 têm sido objeto de intensa farmacovigilância desde o seu lançamento. Suas vendas continuam crescendo devido aos benefícios no controle glicêmico e na perda de peso. Os dados ainda são conflitantes: estudos não desenhados para avaliar especificamente o risco de progressão da RD sugerem esse desfecho, enquanto outros estudos demonstram ausência de efeitos adversos e até mesmo possível neuroproteção retiniana.
O estudo clínico FOCUS — randomizado, prospectivo, controlado e duplo-cego — está avaliando a relação entre análogos de GLP-1 e RD em pacientes com diabetes tipo 2. Os primeiros resultados são esperados para 2027. Até o momento, a Academia Americana de Oftalmologia (AAO) não publicou recomendações oficiais acerca da piora da RD com o uso desses medicamentos.
O avanço dos estudos trará informações consistentes e valiosas para a prática clínica. Para muitos pacientes, o controle glicêmico e a diminuição do risco cardiovascular superam o potencial risco de piora da RD. O especialista em retina recomenda acompanhamento oftalmológico rigoroso e mensal nos primeiros 12 a 18 meses de uso da medicação.
Referências bibliográficas
- Bliss M. The Discovery of Insulin. University of Chicago Press; 2007.
- Nauck MA, Meier JJ. Incretin hormones: Their role in health and disease. Diabetes Obes Metab. 2018;20(S1):5–21.
- Davies MJ, et al. Efficacy and safety of semaglutide versus placebo in patients with type 2 diabetes on basal insulin (SUSTAIN 5). Lancet Diabetes Endocrinol. 2017;5(5):377–388.
- Holst JJ. The physiology of glucagon-like peptide 1. Physiol Rev. 2007;87(4):1409–1439.
- Gerstein HC, et al. Cardiovascular and renal outcomes with semaglutide in type 2 diabetes. N Engl J Med. 2016;375(19):1834–1844.
- Mann JFE, et al. Semaglutide and renal outcomes in type 2 diabetes: post hoc analysis of a randomized trial. Diabetologia. 2020;63(9):1987–1998.
- Marso SP, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2016;375(4):311–322.
- Bethel MA, Diaz R, et al. HbA1c change and diabetic retinopathy during GLP-1 receptor agonist cardiovascular outcome trials: meta-analysis and meta-regression. Diabetes Care. 2021;44(1):290-296.
- Vilsboll T, Bain SC, Leite LA, et al. Semaglutide, reduction in glycated haemoglobin and the risk of diabetic retinopathy. Diabetes Obes Metab. 2018;20(4):889-897.
- The Diabetes Control and Complications Trial Research Group. Early worsening of diabetic retinopathy in the Diabetes Control and Complications Trial. Arch Ophthalmol. 1998;116(7):874–886.
- Simó R, Hernández C. GLP-1R as a therapeutic target beyond diabetes: insights into diabetic retinopathy. Diabetologia. 2018;61(9):1931–1934.
- Fan Y, et al. GLP-1 receptor agonist protects retinal ganglion cells via anti-apoptosis and anti-inflammatory mechanisms in a rat model. Invest Ophthalmol Vis Sci. 2014;55(1):322–332.
- Shor R, Mihalach A, Noori A, et al. Glucagon-like peptide-1 receptor agonist and risk of neovascular age-related macular degeneration. JAMA Ophthalmol. 2025;143(7):587-594.
- Hathaway JP, Shah MP, Hathaway DB, et al. Risk of nonarteritic anterior ischemic optic neuropathy in patients prescribed semaglutide. JAMA Ophthalmol, 2024;142(8):732-739.