Talita de Toledo Lima
Médica pela Universidade Federal de Goiás Residência Médica e Fellowship em Retina pelo Centro de Referência em Oftalmologia e Centro Brasileiro de Cirurgia de Olhos Mestre em Ciências da Saúde / Universidade Federal de Goiás Doutoranda em Ciências da Saúde / Universidade Federal de Goiás The Vision Center at Children s Hospital Los Angeles Observership Program
Em 2018, Motta et al, à análise das distrofias mais prevalentes na coorte brasileira em estudo, identificaram entre as mais prevalentes DHR: retinose pigmentar não sindrômica (35%), doença de Stargardt (21%), amaurose congênita de Leber (ACL) (9%) e distrofias retinias hereditárias sindrômicas (12%), sendo a frequência relativa das DHR no Brasil, semelhantes às relatadas globalmente5.
Desde a descrição – em 1984 – do primeiro gene relacionado a retinose pigmentar ligada ao X, houve um aumento relevante no número de genes identificados nas últimas duas décadas6. Em 2019, 271 genes associados a DHR encontravam se descritos7. No entanto, a notável heterogeneidade genética das DHR não se deve exclusivamente ao número de genes envolvidos, mas ao fato que mutações em um gene específico podem causar fenótipos distintos com características de progressão e padrões de herança diferentes8.
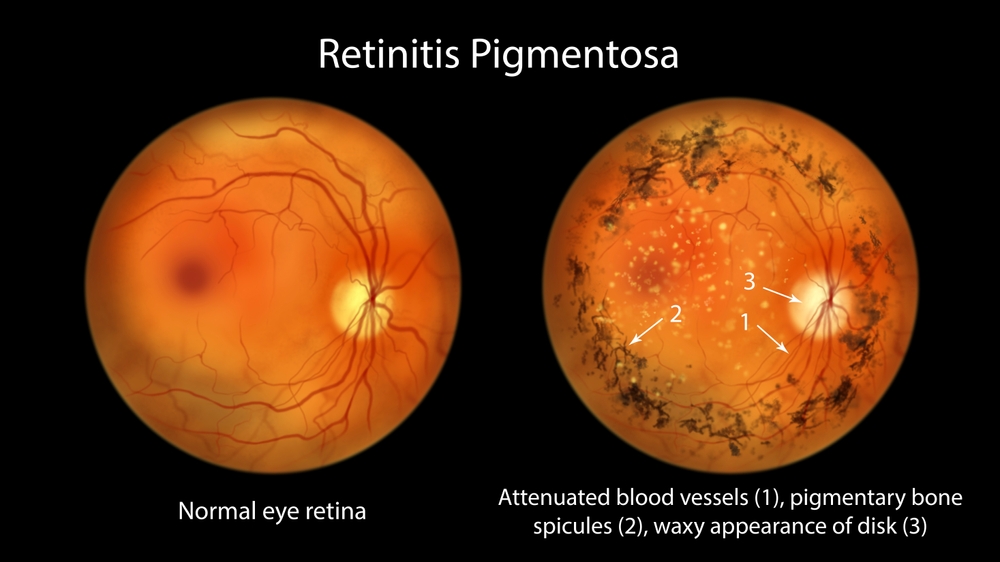
Estas desordens, geralmente afetam a retina bilateralmente e de forma simétrica, sendo as formas sindrômicas frequentemente relacionadas a achados sistêmicos como: surdez neurossensorial, comprometimento neurológico, nefropatia e outros. O diagnóstico pode ser realizado pelo exame clínico e exames complementares que incluem: retinografia, autofluoresceinografia, tomografia de coerência óptica, eletrorretinografia e campo visual. Não obstante, dada a natureza genética heterogênea e a extrema especificidade das modalidades de tratamento atuais, o teste genético tornou-se ferramenta essencial ao diagnóstico9. O desenvolvimento do sequenciamento de nova geração (NGS), transformou o campo do diagnóstico molecular ao permitir o sequenciamento rápido do genoma completo e do exoma total a custos mais baixos. Mas o método Sanger de sequenciamento ainda se aplica para confirmação de mutações e sequenciamento de mutações intrônicas profundas, não lidas adequadamente pelo método NGS10.
Neste contexto de significativa diversidade genética entre os pacientes com DHR, de dificultosa correlação fenotípica-genotípica e da necessária acurácia diagnóstica, dados os riscos de uma cirurgia bilateral para terapia gênica, o estabelecimento de um diagnóstico genético sólido é essencial e deve ser apoiado por bancos de dados de variantes atualizados, bem como análises de segregação.
Em seis de agosto de 2020, a ANVISA aprovou a primeira terapia gênica no Brasil: Voretigeno Nepavoreque (VN) (LuxturnaTM, Novartis). O VN representa o resultado de quase três décadas de pesquisa, liderada por Jean Bennett, Albert Maguire e Michael Redmond, dentre muitos outros11. Caracteriza-se por um vetor viral adenovírus associado (AAV) contendo o cDNA RPE65 humano (AAV2-hRPE65v2), aprovado pela Food and Drug Administration (FDA) dos Estados Unidos em dezembro de 2017 como a primeira terapia gênica para uma condição hereditária após Russell e colaboradores publicarem os resultados do ensaio clínico fase III (NCT00999609)12. Os pacientes tratados durante a fase I do desenvolvimento da medicação sugeriram uma eficácia por até 7 anos (NCT01208389)13.
Durante estas quase três décadas de pesquisa e desenvolvimento, a história da terapia gênica ensinou nos muito. Em 1999, o caso Gelsinger foi uma importante reflexão aos cientistas envolvidos nos ensaios clínicos para terapia gênica à época. Em maio de 2001, Gregory M. Acland, Gustavo D. Aguirre, Jharna Ray, Qi Zhang, Susan E. Pearce-Kelling (Cornell University College of Veterinary Medicine) ; Tomas S. Aleman, Artur V. Cideciyan, Vibha Anand, Yong Zeng, Albert M. Maguire, Samuel G. Jacobson, Jean Bennett (University of Pennsylvania) e William W. Hauswirth (University of Florida, Gainesville) publicaram na Nature Genetics como a terapia gênica pode restaurar a visão em Lancelot, o pastor Briard portador de uma deficiência visual precoce, severa e semelhante à ACL11. Lancelot não somente foi um modelo animal à época, mas o “porta-voz” de uma nova era ao conscientizar o público sobre um tópico complexo. Além de expandir as estratégias de tratamento e atrair financiamentos para a doença responsável por 5% das DHR e 20% da cegueira em crianças em idade escolar. Atualmente, a terapia gênica para ACL mediada por RPE65 é uma realidade em nove instituições selecionadas nos Estados Unidos, mas há ao menos 27 ensaios clínicos em andamento para outras distrofias retinianas.
Um relevante número de pacientes candidatos a terapia gênica no futuro é previsto quando analisada a prevalência global estimada de DHR autossômicas recessivas: 5,5 milhões de pessoas14. Avaliando-se a acurácia diagnóstica atual dos testes genéticos baseados nos painéis de DHR, 40 a 76% dos pacientes devem receber o diagnóstico genético.
Os avanços na escolha da técnica cirúrgica, seja por injeções intravítreas ou subretinianas, bem como as novas abordagens para doenças não passíveis de substituição gênica tradicional, como condições autossômicas dominantes, ilustram como a medicina gênica precisa está sendo empregada no tratamento futuro das DHR15.
Logo, uma abordagem multidisciplinar é fundamental no tratamento dos pacientes com DHR, dada a complexa natureza de atendimento e acessibilidade. Esta equipe deve incluir um especialista em retina – preferencialmente com treinamento em DHR – um geneticista, um especialista em visão subnormal, um assistente social, além de profissionais capacitados a realizarem exames específicos considerados endpoints como o teste de mobilidade de multi- luminância. Todos estes profissionais desempenham papéis essenciais para que estes pacientes sejam atendidos e acompanhados em todos os níveis, principalmente quando o acompanhamento e tratamento abrange crianças que podem não cooperar com medidas padronizadas como testes de sensibilidade à luz ou campos visuais.
Assim que o tratamento cirúrgico é indicado, a terapia gênica com o Voretigeno Nepavoreque é realizada por cirurgiões vitreorretinianos selecionados e treinados, com vitrectomia via pars plana seguida da injeção subretiniana de 1,5 x 1011 genomas vetoriais de VN em um volume total de 0.3ml. O local da injeção deve ser a pelo menos dois dois milímetros da fóvea, ao longo da arcada temporal superior10. Os eventos adversos relacionados incluem: elevação transitória da pressão intraocular, catarata e roturas retinianas. O rótulo do FDA para VN contra recomenda seu uso em crianças menores de 12 meses de idade pela divisão celular retiniana em curso, podendo diluir o material genético. Segundo Koulisis e Nagiel, a paciente mais jovem tratada com LuxturnaTM, foi uma menina com 22 meses de vida por ACL no Children s Hospital de Los Angeles.
No Brasil, o estudo dos achados clínicos e moleculares de uma coorte de 152 pacientes (137 famílias) portadores de ACL e distrofia retiniana severa de início precoce (DRIP) – recentemente publicada – evidenciou 15 genes relacionados ao fenótipo. A maioria dos genes mudados foram CEP290 (21%), RPE65 (16%), CRB1 (14%), RPGRIP1 (10%), GUCY2D (8%), and RDH12 (8%), representando 77% dos casos16.
Diante dos inúmeros questionamentos desta nova era – que englobam desde o diagnóstico, os custos e a formação de uma equipe multidisciplinar treinada neste processo – serão notórios os avanços peculiares a cada centro e sua população, haja vista a diversidade das DHR.
Referências bibliográficas:
1. Daiger, S.P., S.J. Bowne, and L.S. Sullivan, Perspective on genes and mutations causing retinitis pigmentosa. Arch Ophthalmol, 2007. 125(2): p. 151-8.
2. Bourne, R.R.A., et al., Magnitude, temporal trends, and projections of the global prevalence of blindness and distance and near vision impairment: a systematic review and meta-analysis. Lancet Glob Health, 2017. 5(9): p. e888-e897.
3. Solebo, A.L., L. Teoh, and J. Rahi, Epidemiology of blindness in children. Arch Dis Child, 2017. 102(9): p. 853-857.
4. Censo Demográfico 2010: Características gerais da população, religião e pessoas com deficiência. 2010.
5. Motta, F.L., et al., Relative frequency of inherited retinal dystrophies in Brazil. Sci Rep, 2018. 8(1): p. 15939.
6. Bhattacharya, S.S., et al., Close genetic linkage between X-linked retinitis pigmentosa and a restriction fragment length polymorphism identified by recombinant DNA probe L1.28. Nature, 1984. 309(5965): p. 253-5.
7. S., D. RetNet: summaries of genes and loci causing retinal diseases 2019. 2019; Available from: https://sph.uth.edu/retnet/sum-dis.htm#D-graph.
8. Karali, M. and S. Banfi, Inherited Retinal Dystrophies: the role of gene expression regulators. Int J Biochem Cell Biol, 2015. 61: p. 115-9.
9. Hafler, B.P., Clinical Progress in Inherited Retinal Degenerations: Gene Therapy Clinical Trials and Advances in Genetic Sequencing. Retina, 2017. 37(3): p. 417-423.
10. Koulisis, N. and A. Nagiel, Precision Therapy for Inherited Retinal Disease: At the Forefront of Genomic Medicine. Clin Lab Med, 2020. 40(2): p. 189-204.
11. Acland, G.M., et al., Gene therapy restores vision in a canine model of childhood blindness. Nat Genet, 2001. 28(1): p. 92-5.
12. Russell, S., et al., Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: a randomised, controlled, open- label, phase 3 trial. Lancet, 2017. 390(10097): p. 849-860.
13. Bennett, J., et al., Safety and durability of effect of contralateral-eye administration of AAV2 gene therapy in patients with childhood-onset blindness caused by RPE65 mutations: a follow-on phase 1 trial. Lancet, 2016. 388(10045): p. 661-72.
14. Hanany, M., C. Rivolta, and D. Sharon, Worldwide carrier frequency and genetic prevalence of autosomal recessive inherited retinal diseases. Proceedings of the National Academy of Sciences, 2020. 117(5): p. 2710-2716.
15. Cong, L., et al., Multiplex genome engineering using CRISPR/Cas systems. Science, 2013. 339(6121): p. 819-23.
16. Sallum, J.M.F., et al., Clinical and molecular findings in a cohort of 152 Brazilian severe early onset inherited retinal dystrophy patients. Am J Med Genet C Semin Med Genet, 2020.
Fonte: Revista Universo Visual